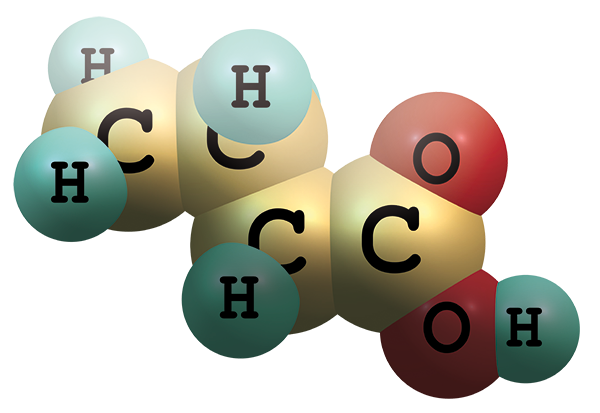
Molekula butyrátu se skládá ze tří atomů uhlíku a zbytku kyseliny karboxylové. Hlavními producenty butyrátu ve střevě jsou bakterie druhu Faecalibacterium prausnitzi nebo Eubacterium rectale.
Schopnost butyrátu podporovat proliferaci normálních buněk a u nádorových indukovat diferenciaci či apoptózu je nazývána butyrátovým paradoxem (Lupton 2004). Předpokladem pro správný účinek butyrátu je jeho dostatečný příjem. Ten se uskutečňuje skrze specializované transportéry. Jeden z nich, SLC5A8, byl popsán jako nádorový supresorový gen, jehož exprese je potlačena až u 60 % nádorů (Li et al. 2003).
Butyrát reguluje buněčné procesy spojené s odbouráváním volných radikálů. Mechanizmus, který by za tuto regulaci mohl být zodpovědný, je butyrátem kontrolována zvýšená exprese detoxikačních enzymů, mezi které patří glutation-S-transferáza. Díky tomu může butyrát chránit buňky před poškozením DNA reaktivními kyslíkovými metabolity, zejména H2O2 (Hamer et al. 2008). Butyrát tak může sloužit i jako primární chemoprevence (Scheppach and Weiler 2004).
Butyrát ovlivňuje také transkripci genů pro některé cytokiny, včetně genů pro komponenty signálních drah zapojených do procesu zánětu. Dochází k inhibici aktivace signální dráhy NF-κβ, produkce interferonu γ a zvýšení exprese receptoru aktivovaného peroxizomovými proliferátory γ (PPARγ) (Hamer et al. 2008, Fung et al. 2012). Tyto vlastnosti předurčují butyrát pro využití v léčbě zánětlivého onemocnění střeva (Van Immerseel et al. 2010). Disbióza v těchto onemocněních hraje velkou roli, protože bylo prokázáno, že pacienti s ulcerózní kolitidou mají výrazně snížený výskyt butyrát produkujících bakterií Roseburia inulinivorans a Faecalibacterium prausnitzii (Machiels et al. 2014).
Butyrát zřejmě hraje svoji úlohu i ve zmírňování příznaků atopického ekzému. Vědci charakterizovali mikrobiom u 6-ti měsíčních dětí, které trpěly tímto onemocněním. Závažnost postižení ekzémem nepřímo korelovala s mikrobiální diverzitou a s množstvím bakterií produkujících butyrát.
Butyrát podporuje těsná spojení střevního epitelu a tím pomáhá zajišťovat bariérovou funkci střeva v obraně před patogeny (Plöger et al. 2012).
Je známým faktem, že strava bohatá na vlákninu pomáhá chránit před obezitou a rezistencí na inzulín. V nedávné metagenomické studii vědci zjistili, že obézní lidé mají výrazně snížený počet bakterií produkujících butyrát (Qin et al. 2012).
Diabetes I. je spjat s velmi nízkým věkem nástupu onemocnění. Ještě před tím však dochází k vytvoření autoprotilátek proti β buňkám Langerhansových ostrůvků pankreatu, které produkují inzulin. Dětem ve věku 6 měsíců byl analyzován střevní mikrobiom a rozdělení dětí podle těchto výsledků odhalilo propojení mezi stravou, mikrobiomem a vývojem autoprotilátek. Jedna skupina dětí vykazovala velký výskyt bakterií rodu Akkermansia a méně Bacterioides. Druhá skupina kojenců, u které převažovaly bakterie rodu Bacterioides, byla charakteristická brzkým zavedením bez mléčné stravy, zvýšeným rizikem vytvoření autoprotilátek proti β buňkám Langerhansových ostrůvků pankreatu a zároveň nižším výskytem genů pro produkci butyrátu. Na základě těchto výsledků vytvořili vědci hypotézu, že butyrát má ochranou funkci před vývojem autoprotilátek proti β buňkám Langerhansových ostrůvků pankreatu a tím pádem i před rozvinutím diabetu I. (Endesfelder et al. 2016).
Butyrát byl vyhodnocen jako potenciální přístup v léčbě cystické fibrózy (Zeitlin 2000). Zdá se, že exprese funkčního chloridového transportéru CFTR (cystic fibrosis transmembrane conductance regulator) může být znovu obnovena pomocí butyrátu. Proces zatím není plně objasněn, ale zřejmě zahrnuje modulaci transkripční hladiny a správné poskládání CRFT proteinu (Zeitlin 2000). Na X chromozom vázaná adrenoleukodystrofie je porucha lipidového metabolizmu, projevující akumulací nevětvených mastných kyselin s velmi dlouhým řetězcem.
Její příčinou je mutace ABCD1 genu pro lipidový transportér. Inhibitory HDAC, jako butyrát, snižují oxidativní poškození tkáně a navíc, jsou schopné kompenzovat nedostatek funkčního ABCD2 u pacientů s tímto onemocněním (Berger et al. 2010).
Butyrát má dlouhodobý přínos při ischemickém poškození a zřejmě proto najde uplatnění v léčbě cévní mozkové příhody. Preklinická studie ukazuje, že léčba butyrátem stimuluje proliferaci, migraci a diferenciaci buněk u potkanů vystavených permanentní cerebrální ischemii (Kim, Leeds and Chuang 2009).
Butyrát má velmi silný neuroprotektivní efekt u transgenního myšího modelu Huntingtonovy choroby a zdá se tedy být velmi slibným terapeutickým přístupem v léčbě tohoto onemocnění. Mutantní Huntingtnův protein reaguje s transkripčními faktory, což vede ke snížené acetylaci histonů. Podávání phenylbutyrátu při prvním nástupu symptomů onemocnění vede ke zmírnění atrofie neuronů a prodloužení života transgenních myší (Gardian et al. 2005).
Další zajímavý efekt butyrátu je jeho vliv na paměť. Blokování aktivity HDAC ovlivňuje synaptickou plasticitu a paměť, což naznačuje, že HDAC mohou sloužit k návratu chromatinu do represivního stavu a mohou umlčovat transkripci potřebnou pro tvorbu dlouhodobé paměti. HDAC mohou sloužit jako zásadní supresorové geny pro paměť a inhibitory HDAC, jako butyrát, mohou pomoci generovat mnohem trvalejší formy dlouhodobé paměti, což otevírá zcela nový terapeutický potenciál butyrátu (Vecsey et al. 2007).